Descubriendo las Etapas de la Ósmosis

La ósmosis es una forma natural de intercambio de fluidos entre el interior y el exterior de las células. Esta transferencia de fluido se produce cuando dos líquidos se separan por una membrana semipermeable, permitiendo el paso de algunos de sus componentes. Esta técnica se usa en la industria para separar materiales sólidos y líquidos.
El proceso de ósmosis se divide en cuatro etapas: la concentración, la presión osmótica, el equilibrio y la presión de difusión. En la primera etapa, la concentración, ambos líquidos están separados por una membrana semipermeable. Esta membrana permite el paso de algunos componentes, como el agua, pero no otros, como el azúcar. El segundo paso es la presión osmótica, donde el líquido con menor concentración trata de igualar la concentración del líquido con mayor concentración.
En la tercera etapa, el equilibrio, se alcanza cuando el líquido de mayor concentración logra igualar la concentración del líquido de menor concentración. Esto se logra cuando el líquido con mayor concentración comienza a desplazarse hacia el lado de menor concentración. La cuarta etapa es la presión de difusión, donde el líquido de mayor concentración disminuye su concentración hasta que ambos líquidos alcanzan un equilibrio.
La ósmosis es un proceso extremadamente útil en la industria alimentaria, ya que es un principio básico para separar los componentes de los alimentos. Además, se utiliza en la industria farmacéutica para separar los componentes activos de los compuestos inactivos. Por último, se usa en la industria química para separar los componentes sólidos y líquidos de los disolventes.
En conclusión, la ósmosis es un proceso natural de intercambio de fluidos entre el interior y el exterior de las células. Esta técnica se divide en cuatro etapas: la concentración, la presión osmótica, el equilibrio y la presión de difusión. Se usa ampliamente en la industria alimentaria, farmacéutica y química para separar los componentes sólidos y líquidos de los disolventes.
La ósmosis es un fenómeno físico que se produce cuando un líquido se filtra a través de una membrana semipermeable. En esta sección exploraremos qué es la ósmosis, sus etapas y sus diferentes tipos
La ósmosis es un fenómeno físico en el que el agua se mueve a través de una membrana semipermeable desde una solución con una concentración baja de solutos a una con una concentración más alta. Esto se debe a la presión osmótica que se forma entre ambas soluciones. La presión osmótica es la presión que se requiere para detener la ósmosis. El agua se mueve a través de la membrana para equilibrar las concentraciones de solutos de ambas soluciones.
La ósmosis puede ser clasificada en dos grandes categorías: endósmosis y exósmosis. La endósmosis se produce cuando el agua se mueve desde una solución de baja concentración de solutos a una de alto contenido de solutos a través de la membrana. Esto se debe a la presión osmótica que se forma entre ambas soluciones. La exósmosis, por otro lado, es el fenómeno opuesto en el que el agua se mueve desde una solución de alto contenido de solutos a una de baja concentración de solutos a través de la membrana.
Además de la endósmosis y exósmosis, hay otras formas de ósmosis. Un ejemplo de esto es la ísmosis, que es un fenómeno similar a la ósmosis, pero en el que el agua se mueve a través de una membrana semipermeable desde una solución con una concentración de solutos más baja a una solución con una concentración más alta. Otra forma de ósmosis es la inversa ósmosis, en la que el agua se mueve a través de una membrana semipermeable desde una solución con una concentración de solutos más alta a una solución con una concentración más baja.
La ósmosis es un fenómeno físico importante que se encuentra en muchas situaciones naturales y artificiales. La ósmosis es una herramienta útil para separar solutos y disolver sustancias. También se usa en medicina para tratar enfermedades y en la producción de alimentos para mejorar su calidad.
En conclusión, la ósmosis es un fenómeno físico que se produce cuando un líquido se filtra a través de una membrana semipermeable. Esto se debe a la presión osmótica que se forma entre las dos soluciones. Existen diferentes tipos de ósmosis, como endósmosis, exósmosis, ísmosis y reversa ósmosis. La ósmosis es una herramienta útil para separar solutos y disolver sustancias. Se usa también en la medicina y en la producción de alimentos.
¿Qué es la Ósmosis y cuáles son sus Etapas?
La ósmosis es una operación física que se produce cuando dos soluciones de diferente concentración se mezclan. Esto provoca que el líquido se mueva desde la solución más diluida hacia la más concentrada, pasando a través de una membrana semipermeable. La membrana solo permite el paso de algunos componentes de la solución, como el agua, pero evita el paso de otros componentes más grandes, como los iones o las moléculas. Esta operación se utiliza en biología para la absorción de nutrientes por parte de las células.
El proceso de ósmosis consta de tres etapas principales. La primera etapa es conocida como la etapa de equilibrio, en la que la diferencia entre la concentración de los componentes en ambos lados de la membrana se estabiliza. La segunda etapa se conoce como la etapa de flujo, en la que el líquido comienza a pasar a través de la membrana, desde la solución más diluida hacia la más concentrada. La tercera etapa se conoce como la etapa de saturación, en la que la presión osmótica alcanza un punto en el que no hay más flujo a través de la membrana.
La ósmosis se utiliza en la industria para separar y purificar líquidos, así como en la agricultura para la irrigación de los cultivos, ya que el proceso de ósmosis ayuda a mejorar la calidad de suelo. También se utiliza en la industria alimentaria para envasar y conservar alimentos. Además, se utiliza en la medicina para la purificación de líquidos corporales, como la sangre y la orina.
En conclusión, la ósmosis es un proceso natural que se produce cuando dos soluciones de diferentes concentraciones se mezclan. Este proceso ayuda a la absorción de los nutrientes por parte de las células, y se utiliza en la industria para separar, purificar y envasar los líquidos, así como en la medicina para la purificación de líquidos corporales. La ósmosis consta de tres etapas principales: la etapa de equilibrio, la etapa de flujo y la etapa de saturación.
La ósmosis es un proceso natural importante que se encuentra en la naturaleza y que se utiliza en muchas industrias. En esta sección de nuestro artículo, descubriremos las etapas de la ósmosis y tres ejemplos de cómo se aplica
La ósmosis es un proceso natural que ocurre cuando dos soluciones con diferentes concentraciones de solutos se separan por una membrana semipermeable. Esta membrana permite el paso de una cantidad determinada de solvente para igualar la concentración de solutos de ambas soluciones. En la naturaleza, el proceso de ósmosis se utiliza para regular el equilibrio de líquidos en los organismos vivos, como los humanos. Además, se utiliza en muchas industrias para una variedad de fines. A continuación, explicaremos las etapas de este proceso y daremos algunos ejemplos de su aplicación.
La ósmosis consta de tres etapas principales: la difusión, la reabsorción y la presión osmótica. Durante la difusión, el solvente se mueve libremente a través de la membrana semipermeable para igualar la concentración de solutos de ambas soluciones. Durante la reabsorción, el solvente es absorbido por la membrana, lo que permite que la diferencia de concentración de solutos se mantenga. Finalmente, la presión osmótica es la presión que se genera entre las dos soluciones, lo que impide que el equilibrio se rompa.
La ósmosis se aplica en una variedad de industrias, como la alimentaria, la farmacéutica y la textil. Por ejemplo, en la industria alimentaria, se utiliza para separar ingredientes, como el azúcar o el agua. En la industria farmacéutica, se utiliza para purificar los medicamentos. Por último, en la industria textil, se utiliza para procesar y acondicionar los materiales. Como puede ver, la ósmosis es un proceso natural importante que se utiliza en muchas industrias.
Filtros de agua para osmosis inversa

Sistema de filtro de agua de ósmosis inversa de 3 etapas para acuario-encimera -100GPD
- ALTA EFICIENCIA: sistema de filtración de agua potable de ósmosis inversa de 3 etapas de hasta 0,0001 micrones, reduce el 99% de arsénico, plomo, mercurio, fluoruro, dureza, cadmio, cloro y más de 1000 contaminantes. Diseño especial para su uso en acuarios.
- ALTA CALIDAD: todos los tubos, accesorios de empuje rápido, membrana Ro compuesta de película delgada cumplen con la norma 58 de NSF/ANSI para proporcionar agua pura saludable y de excelente sabor.
- INTELIGENTE: tamaño inteligente, capacidad: 100 galones por 24 horas, puede instalarlo en cualquier lugar, la proporción de agua pura y agua residual es de 1:2. Enjuague los filtros nuevos 30 minutos
- Sin tanque y sin grifo, no puede funcionar de forma automática. pero hay disponible un kit de agua potable adicional con tanque de 2,8 galones, Amazon asin: B07D9JKSLJ o B07DBZN79S. Perfecto para apartamentos, casas rodantes, viajes de negocios, vacaciones, yates, barcos, casas móviles o en cualquier lugar donde necesite el agua pura.
- El sistema viene con todas las piezas para una fácil experiencia de bricolaje. No pierda dinero en una instalación profesional, puede comprender todo sobre su sistema e instalarlo con nuestras instrucciones claras y bien organizadas en un par de horas. NOTA: No se puede encender y apagar automáticamente, si desea agregar un sistema de control, comuníquese con nosotros

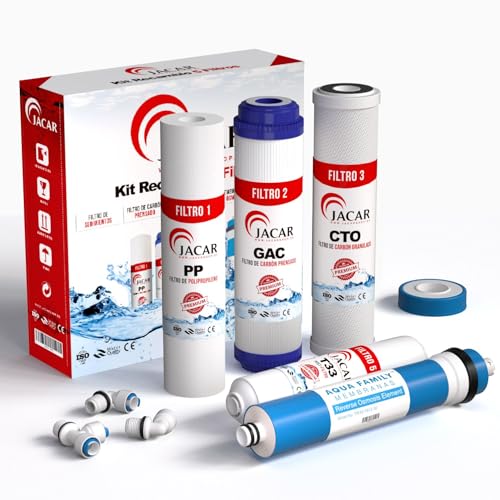
JACAR - Pack Membrana + Filtros de Ósmosis Inversa de 5 etapas Universales | Compatible con todos los sistemas de ósmosis | Recambios de filtros depuradores de agua
- 🔴 FILTROS DE OSMOSIS INVERSA PARA 1 AÑO: Nuestro paquete incluye los 4 filtros esenciales y una membrana de alta calidad de 50 GPD, junto con terminales y teflón. Con este kit de filtros de osmosis completo, disfrutarás de la tranquilidad de tener agua de calidad en tu hogar durante 12 meses sin preocuparte por recambios constantes.
- 🟢 COMPATIBILIDAD 100% CON TODAS LAS MARCAS DE OSMOSIS INVERSA: Nuestros filtros son perfectamente compatibles con el 100% de los sistemas de osmosis inversa NO COMPACTAS (consulta la foto número 3 para identificar los equipos no compactos).
- 🔵 BENEFICIOS: Ideal para cocinar y lavar tus alimentos para evitar los componentes nocivos que entren en nuestro organismo. Evita la cal en tus electrodomésticos como cafeteras, planchas, vaporeras, acuarios, etc. Para los deportistas, se acabó comprar agua embotellada.
- 🟡 ENCUENTRA INSTRUCCIONES DETALLADAS Y ESQUEMA DE MONTAJE: Puedes consultar nuestras instrucciones y el esquema de montaje detallado. Más abajo encontrarás más fotos en las cuales te explicamos lo fácil y sencillo que es el proceso de instalación para que lo puedas hacer tú mismo.
- 👀 GARANTÍA DE SATISFACCIÓN 100%: Estamos tan seguros de la calidad de nuestros filtros de osmosis que ofrecemos una GARANTÍA DE SATISFACCIÓN COMPLETA. Si no estás completamente satisfecho con tu compra, te garantizamos un reembolso total o un reemplazo.


Jacar Pack de 4 Filtros Ósmosis Inversa de 5 Etapas (COMPATIBLE CON TODAS LAS MARCAS) Kit de Filtro Osmosis Inversa 4 etapas, Recambios de Filtros Agua Osmosis Inversa para Equipos Domesticos
- 🔴 FILTROS DE OSMOSIS INVERSA PARA 1 AÑO: Nuestro paquete incluye los 4 filtros de Osmosis junto con terminales y teflón. Con este kit de filtros de osmosis completo, disfrutarás de la tranquilidad de tener agua de calidad en tu hogar durante 12 meses sin preocuparte por recambios constantes.
- 🟢 COMPATIBILIDAD 100% CON TODAS LAS MARCAS DE OSMOSIS INVERSA: Nuestros filtros son perfectamente compatibles con el 100% de los sistemas de osmosis inversa NO COMPACTAS (consulta la foto número 3 para identificar los equipos no compactos).
- 🔵 BENEFICIOS: Ideal para cocinar y lavar tus alimentos para evitar los componentes nocivos que entren en nuestro organismo. Evita la cal en tus electrodomésticos como cafeteras, planchas, vaporeras, acuarios, etc. Para los deportistas, se acabó comprar agua embotellada.
- 🟡 ENCUENTRA INSTRUCCIONES DETALLADAS Y ESQUEMA DE MONTAJE: Puedes consultar nuestras instrucciones y el esquema de montaje detallado. Más abajo encontrarás más fotos en las cuales te explicamos lo fácil y sencillo que es el proceso de instalación para que lo puedas hacer tú mismo.
- 👀 GARANTÍA DE SATISFACCIÓN 100%: Estamos tan seguros de la calidad de nuestros filtros de osmosis que ofrecemos una GARANTÍA DE SATISFACCIÓN COMPLETA. Si no estás completamente satisfecho con tu compra, te garantizamos un reembolso total o un reemplazo.


Kit de 4 Filtros Universales para Osmosis Inversa - Incluye Membrana para Equipo de 5 Etapas Universal y Conectores Postfiltro - 75GPD - Nature Water Professionals, Polipropileno.
- 💧 KIT DE 4 FILTROS PARA OSMOSIS: este kit ideal para tu osmosis inversa incluye todo lo que necesitas. Por un lado, tiene 4 filtros de osmosis inversa y una membrana de 75GPD universales. Por otro lado, contiene un pack de conectores para postfiltro de ¼ y para tubo de ¼. Por último, viene con instrucciones para su sustitución, por lo que su uso es fácil.
- 👌🏼 INCLUYE MEMBRANA PARA EQUIPO 5 ETAPAS: este kit para tu osmosis inversa no solo te ofrece los filtros, también viene con una membrana de 75GPD universales. Este kit es compatible con el 99% de los equipos de osmosis de 5 etapas no compactados. Importante: se recomienda su cambio cada 12 meses. Esta membrana tiene un rechazo bajo y es de larga duración.
- 🚰 INCLUYE CONECTORES POSTFILTRO: además de los 4 filtros y la membrana de este kit, podrás disfrutar de un pack ideal para tu osmosis de 5 etapas que contiene dos conectores, uno para postfiltro de ¼ y otro para tubo de ¼. Para sacar el máximo partido a este producto es importante comprobar el tipo de tubería existente para asegurar la compatibilidad. Incluye 1 postfiltro que mejora el sabor del agua.
- 💦 INCLUYE CARTUCHOS: este kit incluye un cartucho de sedimentos de 5 micras que se encarga de eliminar sedimentos sólidos en suspensión como tierra, barro o arena. También, un cartucho de carbón granulado que elimina el cloro, materiales pesados, pesticidas y olores por absorción. Por último, un cartucho de carbón block para eliminar cualquier traza de cloro y sabores que se esparcen en partículas más pequeñas.
- 🔧 MODO DE USO: tiene un uso muy sencillo gracias a que viene con un libro de instrucciones donde te detalla paso a paso cómo instalarlo y cómo sustituirlo cada año para que puedas hacerlo tu mismo en la comodidad de tu casa, de tu oficina o de tu lugar de trabajo.

Membranas de osmosis inversa

Geekpure Universal Compatible 50 GPD membrana de ósmosis inversa recambio - NSF Certificado elimina 98% de contaminantes en agua
- Alta eficiencia: rechaza impurezas de hasta 0,0001 micrones, elimina arsénico, plomo, mercurio, fluoruro, dureza, cadmio y más de 1000+ contaminantes de la fuente de agua.
- Alta calidad - Certificado NSF/ANSI Standard 58. Material compuesto de película de poliamida, grado alimenticio y no tóxico, sin BPA
- Compatible con Universal - Tamaño estándar (Dimensiones de la membrana: 11,75 "x 1,75"), Se adapta a las carcasas de membrana de ósmosis inversa residencial 1812/2012 (2” de diámetro interior). Si su membrana no es estándar, considere comprar juntos nuestra carcasa de membrana. producto ASIN: B078W3KKSZ
- Vida útil: depende de la cantidad de uso y la calidad del agua de alimentación. Por lo general, 24 meses o 35.000 galones de agua pura para la mayoría del agua del grifo (200-500 ppm)
- Diseño amigable, fácil instalación. Es adecuado para la mayoría de los sistemas de filtración de agua por ósmosis inversa. Tenga en cuenta que debe lavar la membrana nueva durante 30 minutos. NO CONGELAR


Jacar - Membrana Osmosis de 50 Gpd. Osmosis Inversa 5 Etapas. Membrana Aqua Family 100x100 Universal. Filtro depuradora de agua. (50 GPD)
- Membrana Aquafamily: Una de las mejores membranas a nivel mundial, cumpliendo todos los rigurosos estándares de salud pública.
- Compatibilidad: Adaptabilidad universal para cualquier equipo de osmosis.
- Depuración de agua de 50 gpd (189 litros diarios).
- Máxima calidad en filtración y depuración.
- Contiene los elementos de filtrado más sofisticados, por lo que se eliminan todos aquellos compuestos nocivos.
- Productos testados elegidos y orientados para dar el mejor servicio.
- Garantía de 2 años.
- Peso del producto: 200 gramos.


JACAR - Pack Membrana + Filtros de Ósmosis Inversa de 5 etapas Universales | Compatible con todos los sistemas de ósmosis | Recambios de filtros depuradores de agua
- 🔴 FILTROS DE OSMOSIS INVERSA PARA 1 AÑO: Nuestro paquete incluye los 4 filtros esenciales y una membrana de alta calidad de 50 GPD, junto con terminales y teflón. Con este kit de filtros de osmosis completo, disfrutarás de la tranquilidad de tener agua de calidad en tu hogar durante 12 meses sin preocuparte por recambios constantes.
- 🟢 COMPATIBILIDAD 100% CON TODAS LAS MARCAS DE OSMOSIS INVERSA: Nuestros filtros son perfectamente compatibles con el 100% de los sistemas de osmosis inversa NO COMPACTAS (consulta la foto número 3 para identificar los equipos no compactos).
- 🔵 BENEFICIOS: Ideal para cocinar y lavar tus alimentos para evitar los componentes nocivos que entren en nuestro organismo. Evita la cal en tus electrodomésticos como cafeteras, planchas, vaporeras, acuarios, etc. Para los deportistas, se acabó comprar agua embotellada.
- 🟡 ENCUENTRA INSTRUCCIONES DETALLADAS Y ESQUEMA DE MONTAJE: Puedes consultar nuestras instrucciones y el esquema de montaje detallado. Más abajo encontrarás más fotos en las cuales te explicamos lo fácil y sencillo que es el proceso de instalación para que lo puedas hacer tú mismo.
- 👀 GARANTÍA DE SATISFACCIÓN 100%: Estamos tan seguros de la calidad de nuestros filtros de osmosis que ofrecemos una GARANTÍA DE SATISFACCIÓN COMPLETA. Si no estás completamente satisfecho con tu compra, te garantizamos un reembolso total o un reemplazo.


Kit de 4 Filtros Universales para Osmosis Inversa - Incluye Membrana para Equipo de 5 Etapas Universal y Conectores Postfiltro - 75GPD - Nature Water Professionals, Polipropileno.
- 💧 KIT DE 4 FILTROS PARA OSMOSIS: este kit ideal para tu osmosis inversa incluye todo lo que necesitas. Por un lado, tiene 4 filtros de osmosis inversa y una membrana de 75GPD universales. Por otro lado, contiene un pack de conectores para postfiltro de ¼ y para tubo de ¼. Por último, viene con instrucciones para su sustitución, por lo que su uso es fácil.
- 👌🏼 INCLUYE MEMBRANA PARA EQUIPO 5 ETAPAS: este kit para tu osmosis inversa no solo te ofrece los filtros, también viene con una membrana de 75GPD universales. Este kit es compatible con el 99% de los equipos de osmosis de 5 etapas no compactados. Importante: se recomienda su cambio cada 12 meses. Esta membrana tiene un rechazo bajo y es de larga duración.
- 🚰 INCLUYE CONECTORES POSTFILTRO: además de los 4 filtros y la membrana de este kit, podrás disfrutar de un pack ideal para tu osmosis de 5 etapas que contiene dos conectores, uno para postfiltro de ¼ y otro para tubo de ¼. Para sacar el máximo partido a este producto es importante comprobar el tipo de tubería existente para asegurar la compatibilidad. Incluye 1 postfiltro que mejora el sabor del agua.
- 💦 INCLUYE CARTUCHOS: este kit incluye un cartucho de sedimentos de 5 micras que se encarga de eliminar sedimentos sólidos en suspensión como tierra, barro o arena. También, un cartucho de carbón granulado que elimina el cloro, materiales pesados, pesticidas y olores por absorción. Por último, un cartucho de carbón block para eliminar cualquier traza de cloro y sabores que se esparcen en partículas más pequeñas.
- 🔧 MODO DE USO: tiene un uso muy sencillo gracias a que viene con un libro de instrucciones donde te detalla paso a paso cómo instalarlo y cómo sustituirlo cada año para que puedas hacerlo tu mismo en la comodidad de tu casa, de tu oficina o de tu lugar de trabajo.

Sistemas de ósmosis inversa

ATH - Osmosis Inversa 5 Etapas Genius Pro 50 + Recambios Osmosis Originales


JACAR - Pack Membrana + Filtros de Ósmosis Inversa de 5 etapas Universales | Compatible con todos los sistemas de ósmosis | Recambios de filtros depuradores de agua
- 🔴 FILTROS DE OSMOSIS INVERSA PARA 1 AÑO: Nuestro paquete incluye los 4 filtros esenciales y una membrana de alta calidad de 50 GPD, junto con terminales y teflón. Con este kit de filtros de osmosis completo, disfrutarás de la tranquilidad de tener agua de calidad en tu hogar durante 12 meses sin preocuparte por recambios constantes.
- 🟢 COMPATIBILIDAD 100% CON TODAS LAS MARCAS DE OSMOSIS INVERSA: Nuestros filtros son perfectamente compatibles con el 100% de los sistemas de osmosis inversa NO COMPACTAS (consulta la foto número 3 para identificar los equipos no compactos).
- 🔵 BENEFICIOS: Ideal para cocinar y lavar tus alimentos para evitar los componentes nocivos que entren en nuestro organismo. Evita la cal en tus electrodomésticos como cafeteras, planchas, vaporeras, acuarios, etc. Para los deportistas, se acabó comprar agua embotellada.
- 🟡 ENCUENTRA INSTRUCCIONES DETALLADAS Y ESQUEMA DE MONTAJE: Puedes consultar nuestras instrucciones y el esquema de montaje detallado. Más abajo encontrarás más fotos en las cuales te explicamos lo fácil y sencillo que es el proceso de instalación para que lo puedas hacer tú mismo.
- 👀 GARANTÍA DE SATISFACCIÓN 100%: Estamos tan seguros de la calidad de nuestros filtros de osmosis que ofrecemos una GARANTÍA DE SATISFACCIÓN COMPLETA. Si no estás completamente satisfecho con tu compra, te garantizamos un reembolso total o un reemplazo.


Geekpure Sistema de filtro de agua para osmosis inversa de 6 etapas con pH mineral alcalino + filtro de reiniciación 75GPD
- Tecnología avanzada: filtra hasta 0.0001 micrones. Elimina arsénico, plomo, fluoruro, mercurio, cadmio, olores, metales pesados y más de 1000 contaminantes
- El sistema de Ro regular produce un pH de agua ligeramente ácido a 5-6.5. Esta unidad incluye un filtro de remineralización alcalina de sexta etapa adicional que ajusta el pH del agua pura a 7.5-8.5
- Los componentes de primera calidad garantizan la máxima fiabilidad y un bajo mantenimiento durante muchos años. Todos los tubos, accesorios de empuje rápido, tanque de almacenamiento, membrana Ro tienen certificación NSF, para proporcionar agua pura y saludable. Grifo del fregadero de cocina de lujo SIN PLOMO como última garantía de agua pura en su hogar
- Capacidad del sistema 75 galones por día a 60 psi. Capacidad del tanque 2.8 galones, se adapta a la mayoría de los gabinetes debajo del fregadero, tamaño inteligente para garantizar que obtenga agua pura en todo momento. Tamaño de la tubería: 1/4 pulgadas y 3/8 pulgadas. La proporción de agua pura y aguas residuales es 1: 2. Condición del agua de alimentación: Presión del agua: 40-100 psi, Templado: 40-110 ° F / 5-45 ° C, Ph: 3.0 -11.0, TDS máximo: 2000 ppm de agua del grifo o agua de pozo
- El sistema viene con accesorios de conexión rápida, tubos codificados por colores y videos para una fácil experiencia de bricolaje.No pierda dinero en una instalación profesional, puede comprender todo sobre su sistema e instalarlo con nuestras instrucciones bien organizadas en un par de horas.


Waterdrop G2 RO Sistema de Filtración de Agua por Osmosis Inversa, sin Tanque, 1514 Litros por día, Reduce la Dureza del Agua y El TDS, 1: 1 Puro para Drenar, Listado FCC, WD-G2-W, Blanco
- Filtro avanzado que reduce la dureza del agua: Los filtros integrados compuestos-Filtro CF, y el filtro MRO se combinan para ofrecer una filtración más efectiva. La combinación reduce eficazmente la mayoría de los contaminantes, incluyendo el cloro, metales pesados, TDS, y otros contaminantes más. La filtración precisa reduce al máximo el magnesio y el calcio del agua del grifo. El agua filtrada prolonga la vida útil de las tuberías de su casa y mejora el estado de su piel y su cabello.
- El innovador diseño sin tanque ahorra espacio: El diseño sin tanque garantiza la seguridad del agua potable de su familia. El sistema de ósmosis inversa Waterdrop evita la contaminación secundaria del agua derivada del envejecimiento de los accesorios. Además, ahorra más de un 70% de espacio de almacenamiento bajo, y también garantiza un flujo de agua más rápido y un agua más pura. Tenga en cuenta que este sistema de ósmosis inversa requiere electricidad bajo el fregadero.
- Purifique el agua sin esperar: Una bomba interna y filtros eficientes en el sistema ofrecen un flujo de agua estable y rápido de hasta 1500 litros/día, lo que significa que usted puede obtener un vaso de agua filtrada sólo en 12 segundos. El sistema de filtro de agua RO sin tanque satisface sus necesidades mientras ahorra tiempo, y asegura que cada gota de agua que tome sea pura y fresca.
- Sistema de notificación inteligente y certificación estándar CE: Los indicadores de vida del filtro le notifican automáticamente la vida útil del filtro y su estado de funcionamiento. Esto le ayuda a reemplazar el filtro a tiempo y evitar la contaminación secundaria de los filtros caducados e ineficaces. Este sistema de filtro de agua está certificado por la conformidad europea.
- El diseño integrado facilita la instalación y la sustitución: El avanzado diseño integrado de los circuitos eléctricos y de agua reduce las fugas. La carcasa hermética reduce el ruido. El diseño de los filtros, de tipo "twist-and-pull", facilita la instalación y la sustitución. No se tarda más de 30 minutos en instalar y 3 segundos en sustituir. Nota: Para utilizar este sistema de ósmosis inversa es necesario hacer agujeros e instalar una toma de corriente.
