Cómo realizar ósmosis: ¿Qué se necesita?

La ósmosis es un proceso físico-químico mediante el cual se produce el paso de un disolvente, como el agua, desde una solución más diluida hacia otra más concentrada, a través de una membrana semipermeable.
Para realizar ósmosis se necesitan ciertos elementos y condiciones, como una membrana semipermeable que permita el paso del disolvente y no de las partículas disueltas en él, una solución más concentrada que la solución que se desea diluir y una fuente de energía, como la presión o la gravedad, para impulsar el paso de agua a través de la membrana.
En los laboratorios, la ósmosis se realiza utilizando una serie de aparatos y materiales específicos, como recipientes graduados, pipetas, buretas, membranas semipermeables, soluciones salinas y una fuente de presión externa, como un manómetro o una bomba de vacío.
Es importante entender que la ósmosis es un proceso dinámico y complejo que requiere un buen conocimiento de las propiedades químicas y físicas de las soluciones y la membrana semipermeable utilizadas, así como el control adecuado de todas las variables involucradas en el proceso. Por ello, siempre es recomendable contar con la asesoría de expertos en el tema.
¿Qué se necesita para que se realice el proceso de ósmosis?
La ósmosis es un proceso de difusión que se da en la naturaleza de manera constante, ya sea en la absorción de nutrimentos por las células o en la filtración de las soluciones en los riñones.Para que se lleve a cabo la ósmosis son necesarios ciertos elementos que permiten que el proceso se dé de manera óptima. En primer lugar, se necesita una membrana semipermeable, que es aquella que permite el paso de ciertas sustancias y no de otras.
La membrana semipermeable actúa como un filtro que deja pasar los componentes de menor tamaño, como el agua, y retiene los más grandes, como las sales y los minerales. Otro elemento necesario es una solución hipertónica, que tiene una mayor concentración de solutos que la solución del otro lado de la membrana. De esta forma, se crea un gradiente de concentración que provoca que el agua desplace hacia la solución más concentrada.
Finalmente, es importante tener en cuenta el movimiento de las moléculas. Cuando hay dos soluciones con diferentes concentraciones separadas por una membrana semipermeable, las moléculas de soluto se desplazan desde la solución hasta el otro lado de la membrana. Esto provoca que el volumen de la solución sea más bajo y que, por tanto, se produzca un desplazamiento de agua hacia la solución más concentrada.
¿Qué pasa si tomo agua de ósmosis?
El agua de ósmosis puede ser segura para beber, pero es importante entender sus efectos en el cuerpo humano. Algunos estudios sugieren que el consumo de agua de ósmosis puede afectar negativamente a la salud, especialmente en aquellos que beben agua filtrada exclusivamente por este método.
El agua de ósmosis es tratada para eliminar los contaminantes químicos y biológicos, así como los minerales y sales. Si se bebe agua de ósmosis de forma regular, puede afectar el equilibrio electrolítico del cuerpo, lo que a su vez puede causar problemas digestivos e incluso afectar la función del corazón.
Además, el agua de ósmosis puede no contener los minerales esenciales que se encuentran en el agua del grifo o en agua embotellada. La falta de minerales puede ser perjudicial para la salud a largo plazo, especialmente en áreas donde el agua del grifo no es segura para beber.
En general, el consumo de agua de ósmosis puede ser seguro si se usa adecuadamente y se complementa con una dieta equilibrada y variada de alimentos ricos en minerales. Es importante tomar en cuenta los posibles efectos negativos que el consumo exclusivo de agua de ósmosis puede tener en el cuerpo humano, especialmente en niños y ancianos, que pueden ser más vulnerables a los cambios en el equilibrio electrolítico del cuerpo.
¿Cómo se hace el experimento de ósmosis?
La ósmosis es un proceso fundamental en la biología y la química. Este proceso se refiere al movimiento de un disolvente a través de una membrana semipermeable desde una solución más diluida hacia una más concentrada. En este experimento, se puede estudiar este proceso y sus efectos. Para llevar a cabo el experimento, se necesitan varios materiales.
En primer lugar, se necesitan dos recipientes de vidrio. Uno debe ser más grande que el otro. También se necesita una solución concentrada y otra diluida, así como una membrana semipermeable, que puede ser una bolsa de dialisis.
El primer paso consiste en llenar el recipiente más grande con la solución diluida. Luego, se coloca la bolsa de dialisis en el recipiente más grande.
A continuación, se llena la bolsa de dialisis con la solución concentrada. La bolsa debe sellarse para evitar que la solución se escape.
Finalmente, se coloca el recipiente más pequeño dentro del recipiente más grande, asegurándose de que el recipiente más pequeño esté completamente sumergido en la solución diluida. Y se deja reposar durante unas horas.
Durante este tiempo, se observará que la solución concentrada comenzará a moverse a través de la membrana semipermeable hacia la solución diluida, igualando la concentración en ambos lados de la membrana.
Este experimento demuestra cómo funciona la ósmosis y la importancia de la membrana semipermeable en el proceso. Es un experimento útil no solo para estudiantes de biología y química, sino también para cualquiera interesado en la ciencia detrás de la difusión y la concentración.
Filtros de ósmosis
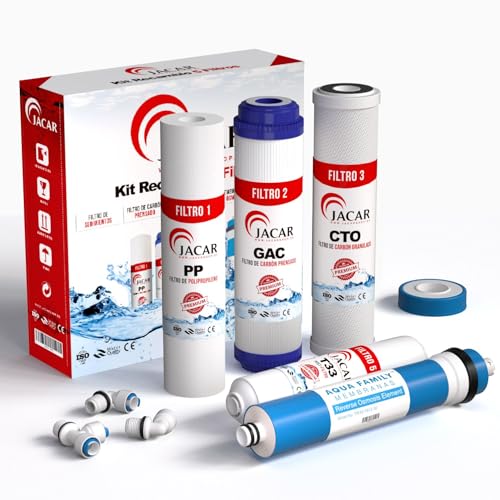
JACAR - Pack Membrana + Filtros de Ósmosis Inversa de 5 etapas Universales | Compatible con todos los sistemas de ósmosis | Recambios de filtros depuradores de agua
- 🔴 FILTROS DE OSMOSIS INVERSA PARA 1 AÑO: Nuestro paquete incluye los 4 filtros esenciales y una membrana de alta calidad de 50 GPD, junto con terminales y teflón. Con este kit de filtros de osmosis completo, disfrutarás de la tranquilidad de tener agua de calidad en tu hogar durante 12 meses sin preocuparte por recambios constantes.
- 🟢 COMPATIBILIDAD 100% CON TODAS LAS MARCAS DE OSMOSIS INVERSA: Nuestros filtros son perfectamente compatibles con el 100% de los sistemas de osmosis inversa NO COMPACTAS (consulta la foto número 3 para identificar los equipos no compactos).
- 🔵 BENEFICIOS: Ideal para cocinar y lavar tus alimentos para evitar los componentes nocivos que entren en nuestro organismo. Evita la cal en tus electrodomésticos como cafeteras, planchas, vaporeras, acuarios, etc. Para los deportistas, se acabó comprar agua embotellada.
- 🟡 ENCUENTRA INSTRUCCIONES DETALLADAS Y ESQUEMA DE MONTAJE: Puedes consultar nuestras instrucciones y el esquema de montaje detallado. Más abajo encontrarás más fotos en las cuales te explicamos lo fácil y sencillo que es el proceso de instalación para que lo puedas hacer tú mismo.
- 👀 GARANTÍA DE SATISFACCIÓN 100%: Estamos tan seguros de la calidad de nuestros filtros de osmosis que ofrecemos una GARANTÍA DE SATISFACCIÓN COMPLETA. Si no estás completamente satisfecho con tu compra, te garantizamos un reembolso total o un reemplazo.


Kit de 4 Filtros Universales para Osmosis Inversa - Incluye Membrana para Equipo de 5 Etapas Universal y Conectores Postfiltro - 75GPD - Nature Water Professionals, Polipropileno.
- 💧 KIT DE 4 FILTROS PARA OSMOSIS: este kit ideal para tu osmosis inversa incluye todo lo que necesitas. Por un lado, tiene 4 filtros de osmosis inversa y una membrana de 75GPD universales. Por otro lado, contiene un pack de conectores para postfiltro de ¼ y para tubo de ¼. Por último, viene con instrucciones para su sustitución, por lo que su uso es fácil.
- 👌🏼 INCLUYE MEMBRANA PARA EQUIPO 5 ETAPAS: este kit para tu osmosis inversa no solo te ofrece los filtros, también viene con una membrana de 75GPD universales. Este kit es compatible con el 99% de los equipos de osmosis de 5 etapas no compactados. Importante: se recomienda su cambio cada 12 meses. Esta membrana tiene un rechazo bajo y es de larga duración.
- 🚰 INCLUYE CONECTORES POSTFILTRO: además de los 4 filtros y la membrana de este kit, podrás disfrutar de un pack ideal para tu osmosis de 5 etapas que contiene dos conectores, uno para postfiltro de ¼ y otro para tubo de ¼. Para sacar el máximo partido a este producto es importante comprobar el tipo de tubería existente para asegurar la compatibilidad. Incluye 1 postfiltro que mejora el sabor del agua.
- 💦 INCLUYE CARTUCHOS: este kit incluye un cartucho de sedimentos de 5 micras que se encarga de eliminar sedimentos sólidos en suspensión como tierra, barro o arena. También, un cartucho de carbón granulado que elimina el cloro, materiales pesados, pesticidas y olores por absorción. Por último, un cartucho de carbón block para eliminar cualquier traza de cloro y sabores que se esparcen en partículas más pequeñas.
- 🔧 MODO DE USO: tiene un uso muy sencillo gracias a que viene con un libro de instrucciones donde te detalla paso a paso cómo instalarlo y cómo sustituirlo cada año para que puedas hacerlo tu mismo en la comodidad de tu casa, de tu oficina o de tu lugar de trabajo.


Pack 4 Filtros Ósmosis Inversa
- Apto para cualquier equipo Standard de ósmosis inversa.Ver más detalles
- Mejor relación Calidad - Precio.
- Postfiltro con sistema de rosca

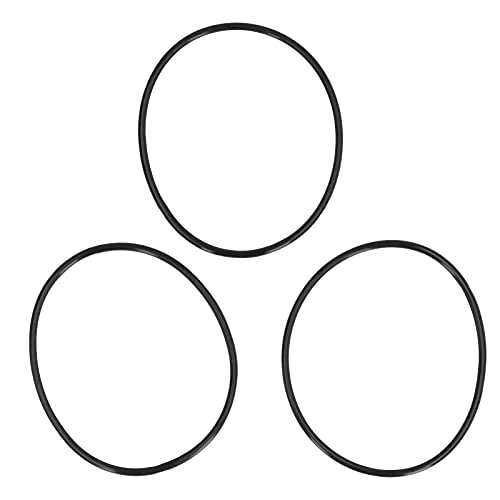
Anillos de sello de goma, sello de nitrilo de repuesto Accesorio perfecto para carcasas de filtro de agua de ósmosis inversa Diámetro 148x140x4.2mm Negro Juego de 3 juntas tóricas
- CAMPO DE APLICACIÓN: Se utiliza en una variedad de aplicaciones como tratamiento de agua potable, piscinas, procesos industriales y más.
- COMPATIBLE: Hecho de caucho de nitrilo de primera calidad, fuerte compatibilidad, compatible con varios productos.
- CALIDAD ESTÁNDAR: Fabricado para cumplir con las especificaciones estándar, siga estrictamente el control de calidad de fábrica.
- RESISTENTE AL AGUA: También tiene buena resistencia al agua, hermeticidad y excelente adherencia.
- JUEGO DE 3 PIEZAS: Incluye 3 juntas tóricas de repuesto (también llamadas juntas o empaquetaduras) para reparar la carcasa del filtro de agua con fugas.

Kits de ósmosis

TIMESETL Manguera de Suministro de Agua Universal de 15 Metros, Kit de Conector de Manguera de Refrigerador de 1/4 ", Tubo de Filtro, Piezas y Accesorios de Refrigerador Europeo / Americano
- Juego Completo de Conectores para Refrigerador: Una línea de agua de 15m 1/4 ", 1 enchufe recto de 1/4", 1 enchufe de codo de 1/4 ", 1 enchufe de 1/4", 1 llave de paso de válvula de 1/4 ", 1 x llave de paso de 1/4 ", 1 x llave de paso de 1/2", 2 x 3/4 ". Grifo, 1 x cortatubos, alicates de cierre de 13 x 1/4 ".
- Alta Compatibilidad: Adecuado para la mayoría de los tipos estándar de refrigeradores y congeladores con dispensadores de agua y máquinas de hielo, como Samsung, Bosch, Miele, LG, Daewoo, Siemens, Neff, etc.
- Fácil de Instalar: El accesorio de liberación rápida a presión se puede instalar fácilmente con un cortatubos afilado, puede cortar rápidamente el tubo a la longitud requerida sin la necesidad de otras herramientas.
- Materiales Duraderos: Tuberías de alta calidad con resistencia al envejecimiento, resistencia al agrietamiento, resistencia a bajas temperaturas, resistencia a la corrosión y resistencia al impacto.
- Ampliamente Utilizado: Para suministrar agua para refrigeradores, sistemas de filtración de ósmosis inversa (RO), máquinas de helados, enfriadores y dispensadores de agua, humidificadores de aire, etc.


HUAZIZ Tubo de Suministro de Agua para Frigorífico de 15 Meter Tubo de Agua para Nevera con kit de Accesorios de Conector para Refrigerador Doble de Estilo Europeo (Tubo de 1/4 de Pulgada)
- Material de alta calidad: el kit de conexión de agua del refrigerador está hecho de materiales de alta calidad, antienvejecimiento, antigrietas, resistencia a bajas temperaturas, anticorrosión y sin productos químicos.
- Fácil de instalar: los accesorios de ajuste rápido le ofrecen una fácil instalación de bricolaje sin necesidad de herramientas adicionales.
- Ampliamente utilizado: suministra agua a refrigeradores, sistemas de filtración de ósmosis inversa (RO), helados, enfriadores y dispensadores de agua, humidificadores y más.
- Con este conjunto puede conectar refrigeradores de dos puertas verticales, sistemas de ósmosis inversa, acuarios y varios filtros de agua al suministro de agua con una manguera de 6,35 mm (1/4").
- Paquete completo: 1 manguera de agua de 1/4" de 15 metros, 3 conexiones instantáneas rectas de 1/4", 3 conexiones instantáneas en codo de 1/4", 3 conexiones en T de 1/4", 2 válvulas Válvula de cierre de 1/4", 1 cortatubos, 3 conectores en Y de 1/4".


1/4" Conector Kit, ilauke 20 Piezas The Water Filter 1/4" Conector (Y + T + I + L + Válvula de Cierre), Kits de instalación para frigoríficos, RO Osmosis Inversa Sistema de Filtro conector de empuje
- Paquete de 20 accesorios de filtro de agua: viene con 4 accesorios de filtro de agua de diferentes formas: 4 codos de empuje tipo L de 1/4 pulgadas, 4 conectores de empuje tipo I de 1/4 pulgadas, 4 adaptadores de conexión rápida en Y de 1/4 pulgadas, 4 conectores de empuje tipo T de 1/4 pulgadas. Todos los tipos de conectores rápidos pueden satisfacer tus requisitos de instalación.
- Sin fugas: todas las partes de los accesorios de suministro de agua están firmemente conectadas sin fugas. La temperatura del agua puede alcanzar los 300 grados, y son accesorios estándar del sistema de filtración de agua que no se deforma fácilmente.
- Duradero y seguro: hecho de materiales POM de grado alimenticio, nuestros conectores rápidos enchufables han sido cuidadosamente procesados, con superficie lisa, sin rebabas. Rendimiento fiable y buena dureza que te permiten reutilizarlos de forma segura.
- Fácil instalación: el interior de la entrada de agua universal se fija con garras de acero y tiene roscas de instalación claras y profundas. Simplemente alinea el conector con el tubo, insértalo en la parte inferior del tubo y apriétalo. No requiere herramientas adicionales.
- Amplia aplicación: los conectores purificadores de agua multifuncionales son aplicables a la conexión rápida de la mayoría de los sistemas de filtro de agua estándar de 1/4 RO. Adecuado para máquinas de ósmosis inversa, filtros de agua, refrigeradores, máquinas de hielo, oolers de agua, humidificadores y mucho más.


FOCCTS 15 metros manguera de suministro de agua tubo y kit de conectores de refrigerador para refrigerador de estilo europeo doble refrigerador (1/4"pipe)
- Paquete completo: tubo de agua de 15 metros de 1/4 pulgadas, 1 conector recto de 1/4 pulgadas, 1 codo de 1/4 pulgadas, 1 conector de grifo de 1/4 pulgadas, 1 conector de grifo de 1/4 pulgadas. 2 x 3 Conector de grifo de 4 pulgadas, 1 válvula de cierre en línea de 1/4 pulgadas, 1 cortador de rosca
- 【Fuerte compatibilidad】Se adapta a la mayoría de los tipos de frigorífico-congeladores, como los modelos fabricados por: Samsung, Bosch, Miele, LG, Daewoo, Siemens, Neff y muchos otros.
- Fácil de instalar: los accesorios de conexión rápida a presión proporcionan una fácil instalación de bricolaje, no necesita herramientas adicionales
- Ampliamente utilizado: proporciona agua a refrigeradores, sistema de filtro de ósmosis inversa (RO), máquinas de hielo, enfriadores de agua y dispensadores, humidificadores y mucho más
- Alta calidad: fabricado especialmente para un requisito de tamaño preciso.

Membranas de ósmosis

Antibiofouling enhancement of Reverse Osmosis Membrane: Principles and Approaches


Reverse Osmosis Membrane Research: Based on the Symposium on Polymers for Desalination Held at the 162nd National Meeting of the American Chemical Soc


Composite Membrane for Engineered Osmosis Desalination Process


JACAR - Pack Membrana + Filtros de Ósmosis Inversa de 5 etapas Universales | Compatible con todos los sistemas de ósmosis | Recambios de filtros depuradores de agua
- 🔴 FILTROS DE OSMOSIS INVERSA PARA 1 AÑO: Nuestro paquete incluye los 4 filtros esenciales y una membrana de alta calidad de 50 GPD, junto con terminales y teflón. Con este kit de filtros de osmosis completo, disfrutarás de la tranquilidad de tener agua de calidad en tu hogar durante 12 meses sin preocuparte por recambios constantes.
- 🟢 COMPATIBILIDAD 100% CON TODAS LAS MARCAS DE OSMOSIS INVERSA: Nuestros filtros son perfectamente compatibles con el 100% de los sistemas de osmosis inversa NO COMPACTAS (consulta la foto número 3 para identificar los equipos no compactos).
- 🔵 BENEFICIOS: Ideal para cocinar y lavar tus alimentos para evitar los componentes nocivos que entren en nuestro organismo. Evita la cal en tus electrodomésticos como cafeteras, planchas, vaporeras, acuarios, etc. Para los deportistas, se acabó comprar agua embotellada.
- 🟡 ENCUENTRA INSTRUCCIONES DETALLADAS Y ESQUEMA DE MONTAJE: Puedes consultar nuestras instrucciones y el esquema de montaje detallado. Más abajo encontrarás más fotos en las cuales te explicamos lo fácil y sencillo que es el proceso de instalación para que lo puedas hacer tú mismo.
- 👀 GARANTÍA DE SATISFACCIÓN 100%: Estamos tan seguros de la calidad de nuestros filtros de osmosis que ofrecemos una GARANTÍA DE SATISFACCIÓN COMPLETA. Si no estás completamente satisfecho con tu compra, te garantizamos un reembolso total o un reemplazo.
