¿Cómo influye la presión de un gas?

La presión de un gas es una medida de la fuerza que ejerce el gas sobre las paredes del recipiente que lo contiene. Esta presión tiene un impacto significativo en el comportamiento y las propiedades del gas.
La presión de un gas está determinada por la cantidad de partículas de gas presentes en el recipiente y la velocidad a la que se mueven. Cuando hay más partículas de gas presentes, habrá más colisiones entre las partículas y las paredes del recipiente, lo que resultará en una mayor presión.
Por otro lado, cuando las partículas de gas se mueven a una velocidad más alta, también habrá más colisiones y, por lo tanto, una mayor presión. Estas colisiones pueden ser elásticas o inelásticas, lo que significa que las partículas pueden rebotar entre sí o adherirse entre sí y transferir energía.
La presión de un gas también puede ser influenciada por otros factores, como la temperatura y el volumen del recipiente. Cuando la temperatura de un gas aumenta, las partículas se mueven más rápido y colisionan con mayor frecuencia, lo que aumenta la presión.
Por otro lado, si el volumen del recipiente se reduce, las partículas estarán más cerca unas de otras y colisionarán con mayor frecuencia, lo que también resultará en un aumento de la presión.
En resumen, la presión de un gas está determinada por la cantidad de partículas presentes, su velocidad, la temperatura y el volumen del recipiente. Comprender cómo influye la presión de un gas es fundamental en diversas áreas, como la física y la química, ya que permite predecir el comportamiento de los gases en diferentes condiciones.
¿Qué es la presión de un gas?
La presión de un gas hace referencia a la fuerza que ejerce un gas sobre las paredes de un recipiente en el que se encuentra contenido. Esta fuerza se produce debido a las colisiones de las moléculas del gas contra las paredes del recipiente.
La presión atmosférica es el resultado de la fuerza que ejerce el peso del aire sobre la superficie terrestre. A nivel del mar, la presión atmosférica es de aproximadamente 1 atmósfera, que equivale a 101325 pascales.
La presión absoluta de un gas se refiere a la presión que ejerce el gas en relación con el cero absoluto de presión, que es el vacío total. La presión absoluta se mide en pascales y se utiliza para medir la presión en diferentes unidades, como bares, torr o milímetros de mercurio.
La presión manométrica es la diferencia entre la presión absoluta de un gas y la presión atmosférica. Se utiliza para medir la presión en sistemas cerrados y se expresa en unidades como psi (libras por pulgada cuadrada) o kg/cm².
La ley de Boyle establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. Es decir, si la presión aumenta, el volumen disminuye, y viceversa.
La ley de Charles establece que, a presión constante, el volumen de un gas es directamente proporcional a su temperatura. Si la temperatura aumenta, el volumen también aumenta, y si la temperatura disminuye, el volumen también disminuye.
En resumen, la presión de un gas es la fuerza que ejerce el gas sobre las paredes del recipiente en el que se encuentra contenido. Esta presión puede medirse en unidades como pascales o psi, y puede ser influenciada por factores como la temperatura y el volumen del gas.
¿Cómo puede variar la presion en un gas?
La presión en un gas puede variar de diversas formas, dependiendo de diferentes factores que afectan sus características y propiedades.
Una de las formas en que la presión puede variar es a través de cambios en el volumen del gas. Cuando se reduce el volumen de un gas, las moléculas se encuentran más cercanas entre sí, lo que genera una mayor frecuencia de colisiones y, por lo tanto, un aumento en la presión. Por el contrario, si el volumen se incrementa, las moléculas se alejan y las colisiones disminuyen, resultando en una disminución en la presión.
Otro factor que puede influir en la variación de la presión de un gas es la temperatura. Cuando se aumenta la temperatura de un gas, las moléculas incrementan su velocidad y energía cinética, lo que lleva a una mayor frecuencia de colisiones y, por ende, a un aumento en la presión. Sin embargo, si la temperatura disminuye, las moléculas se mueven más lentamente y las colisiones son menos frecuentes, resultando en una disminución en la presión.
Además, la cantidad de partículas o moléculas presentes en el gas también puede variar la presión. Cuantas más moléculas haya en un volumen determinado, mayor será la probabilidad de colisiones y, por lo tanto, mayor será la presión. En cambio, si se reduce la cantidad de moléculas, habrá menos colisiones y la presión disminuirá.
En resumen, la presión en un gas puede variar debido a cambios en el volumen, la temperatura y la cantidad de moléculas presentes. Estos factores afectan directamente la frecuencia y energía de las colisiones entre las moléculas, lo que a su vez determina la presión del gas.
Medidores de presión de gas

Manómetro diferencial digital medidor de presión de gas de aire de mano, rango de medición ± 103.42KPA
- 11 unidades: el instrumento puede medir presión diferencial/positiva/negativa, tiene 11 unidades de medida seleccionables kPa, mmHg, inHg, psi, mbar, bar, ozin², kgcm², inH₂O, ftH₂O, cmH₂O.
- Pantalla LCD: pantalla grande con luz de fondo, fácil de medir en ambientes oscuros, operación fácil y valor de lectura claro, fácil de transportar.
- Amplias aplicaciones: el manómetro diferencial es adecuado para la medición y verificación in situ de sistemas de ventilación y aire acondicionado, sala limpia o cualquier solución de problemas del sistema de presión de gas.
- Alta calidad: moldeo por inyección doble, fundición única de molde de alta precisión, plásticos de ingeniería ABS de alta resistencia que protegen mejor el cuerpo.
- Herramienta útil: el manómetro diferencial es una herramienta de medición indispensable para los técnicos de HVAC, los ingenieros de operación y mantenimiento y los investigadores científicos.

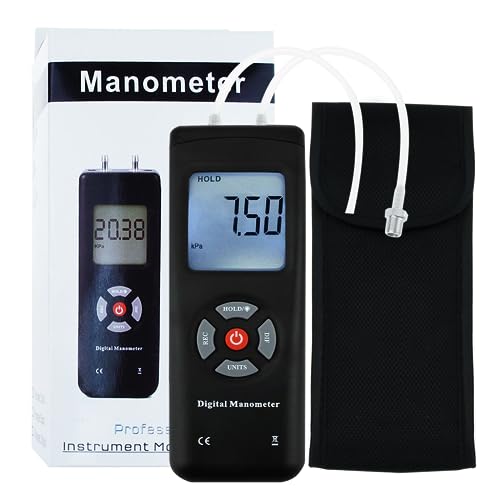
Manómetro Digital Portátil HVAC Para Aspiradora De Aire/gas, Medidor De Presión
- Mide la presión de aire de un solo tubo o la presión diferencial de 2 tuberías. Tiene 11 unidades de medida kPa, psi, kgfcm2, ozin2, bar, inHg, mmHg, inH2O, ftH2O, cmH2O.
- Mejor para medir los sistemas de ventilación y aire acondicionado. Ampliamente utilizado para medición de gas, calibración y cualquier solución de problemas de cualquier sistema de presión de gas.
- Función de grabación de lectura máxima/mínima.
- Indicador de batería baja y función de apagado automático.
- Medición diferencial de presión, gran pantalla LCD con retroiluminación doble.


Manómetro Medidor de presión de gas digital Medidor de presión diferencial Medidor de presión de aire HVAC con función de registro de datos de retroiluminación
- Alta precisión: rango de medición: ± 2.000 psi; precisión: ± 0.3% FSO (a 25 °C). Repetibilidad: ± 0.2% (máximo ± 0.5% FSO); linealidad/histéresis: ± 0.29% FSO
- ✅【12 unidades seleccionables】Cambia fácilmente entre Psi, kPa, Pa, Kgfcm2, ozin2, Bar, mbar, inHg, mmHg, inH2O, ftH2O y cmH2O
- Registro de datos: este manómetro graba 99 piezas de datos con sello de tiempo, lo que ayuda a analizar los datos más fácilmente
- ✅【Multifuncional】Medición de presión diferencial, presión positiva y negativa, retención de datos, media máxima/min, retroiluminación LCD grande, alarma de batería baja, funciones de apagado automático
- ✅【Amplias aplicaciones】Este manómetro de alta calidad es adecuado para sistemas de medición de gas, que miden el sistema de aire y ventilación, calibración y solución de problemas de sistemas de presión de gas, HVAC, reparación e instalación de aparatos de gas, pruebas de laboratorio, etc.


AUTOOL Medidor de presión diferencial digital con conector de doble tubo, medidor de presión de gas/medidor HVAC con pantalla LCD grande y 12 unidades de medida (±20,68 kPa/±2,999 psi)
- 【MEDIDOR DE PRESIÓN DE ALTA PRECISIÓN】 Este es un medidor de presión digital simple y que ahorra tiempo. Adopta un sensor de presión importado, un ADC de alta precisión y un diseño de MCU de baja potencia. Precisión de medición: ± 0,3 % FSO (a 25 ℃); Rango de medición: ± 2.999 Psi. También se puede utilizar para medir la temperatura interior.
- 【CONECTORES SIMPLES Y DOBLES】Hay dos puertos en la parte superior del medidor de presión diferencial, uno para probar la presión positiva y el otro para probar la presión negativa. Con un conector de tubo único, puede medir rápidamente el valor de presión actual (en relación con la presión atmosférica actual), mientras que un conector de tubo doble puede detectar simultáneamente la diferencia de presión entre los dos puertos de detección (P1-P2).
- 【PANTALLA LCD Y 12 UNIDADES DE MEDIDA】La gran pantalla de alta resolución hace que los datos sean claros de un vistazo y es compatible con la retroiluminación LCD. 12 unidades de medida diferentes para elegir: mmHg, inHg, ftH₂O, cmH₂O, inH₂O, Pa, KPa, mbar, bar, psi, Kgcm² y ozin².
- 【DISEÑO HUMANIZADO】 (1) Con función de grabación y retención de datos (Almacenamiento de datos: 100 grupos), conveniente para que los usuarios verifiquen después de la prueba; (2) Se apagará automáticamente después de unos 15 minutos sin funcionar; (3) Recordatorio de batería baja; (4) Función de reinicio de datos, para que sus lecturas sean precisas. (5) 3 años de garantía.
- 【AMPLIA APLICACIÓN】Ampliamente utilizado en tuberías de gas natural, aire acondicionado, sistemas de refrigeración y ventilación, hidráulica mecánica, moldeado de plástico, fabricación de productos cerámicos, moldeado biofarmacéutico, pruebas de presión de minas, fundición de la industria petroquímica, pruebas de presión de equipos industriales de producción, gas y líquidos, pruebas de nivel de líquido, calibración de laboratorios, prueba de micropresión en entornos médicos, etc.
- 【Note】: Antes del uso, es necesario borrar todos los datos anteriores antes de la prueba para garantizar la precisión de la medición.

Reguladores de presión de gas

Ikodm Reductor de presión para argón/CO2, regulador de presión, gas protector a máquina de soldadura MIG/MAG, reductor de presión de aire comprimido
- ✔ Adecuado para muchos tipos de gas, por ejemplo, argón, CO2.
- ✔ Reduce y regula la presión del gas utilizado para trabajos de soldadura. Presión máxima del manómetro: 0-315 bar, caudal: 0-30 l/min.
- ✔ Comparador resistente con exterior lacado o de goma y escala blanca fácilmente legible en la parte inferior. Los relojes comparadores son instrumentos de precisión sin mantenimiento.
- ✔La carcasa está hecha de latón de alta calidad y tiene un diseño compacto que es muy adecuado para la instalación.
- ✔ El reductor de presión de CO2 de argón tiene conexiones estándar alemanas, W 21,8 x 1/14". Dos manómetros, uno para la presión de la botella y otro para la presión de salida. Si tiene alguna pregunta o no está satisfecho con este producto, no dude en ponerse en contacto con nosotros y lo resolveremos lo antes posible, ¡su satisfacción es nuestra máxima prioridad!


Com Gas 200208 - Regulador presión salida 50 mbar
- Regulador presión salida 50 mbar
- Apto para acoplar a aparatos que funcionen con presión de entrada 50 mbar
- Larga vida útil


Regulador de presión para gas de protección Argon/CO2 a soldadora MIG/MAG WIG
- Cuerpo de latón de alta calidad, diseño compacto, ideal para el montaje. Los robustos relojes de medición están lacados o engomados en el exterior y con diales blancos fáciles de leer.
- Los indicadores en el reductor de presión de CO2 están diseñados de forma clara. La regulación del regulador de presión se realiza con regulador giratorio. Presión máxima de la botella: 0-315 bar, caudal: 0-20 litros/minuto.
- El reductor de presión Argon/CO2 es un dispositivo de precisión compacto que no requiere mantenimiento. Reduce y regula la presión de gases para trabajos de soldadura. La válvula es ideal para la aplicación en MIG MAG y TIG.
- El regulador de presión argon CO2 tiene el conector estándar alemán W 21,8 x 1/14 pulgadas. Dos manómetros, uno para la presión de la botella y otro para la presión de salida.
- Aplicable a muchos tipos de gases, como argón, CO2. Herramienta profesional para uso comercial o ocasional. Ideal para muchas aplicaciones. Ligero y portátil.


S&M 321771 Kit completo Regulador de gas butano+ Tubo Goma 1,5 metros + 2 abrazaderas de seguridad, Gris/Naranja
- Kit completo para instalaciones de gas butano y propano. IMPORTANTE: Nuestro producto viene empaquetado en un estuche de seguridad de plástico cerrado con el código de barras 8413380331271
- Incluye: Tubo homologado con una longitud de 1, 5 m+ regulador doméstico butano apto para acoplar a aparatos que funcionen con presión de entrada 30 mbar
- Diámetro interior de la manguera: 9 x 15 mm; fecha de fabricación y caducidad en tubo. El uso de la manguera no debe mantenerse después de su fecha de caducidad
- Caudal garantizado: 2.5 kg/h, presión de alimentación: 0, 6-16 bar y presión de cierre: 63 mbar
- Conexión de entrada: g-56 (une-en 12864); conexión de salida: h-51 (une-en 12864)
- Indicado para cocinas, estufas de gas, calderas, catalíticas, barbacoas, paelleras, calentadores…
- Regulador o alcachofa para botellas de gas para España (excepto Canarias, Ceuta y Melilla que cuentan con su propio regulador S&M 322075 -ASIN B07FR2MVF9) Compruebe el tipo de regulador y la presión de trabajo de su aparato antes de realizar el pedido
- NOTA IMPORTANTE: La caducidad de la goma del gas es de 5 años. En la propia goma debe encontrar el año de fabricación y el año de caducidad. Si la goma que tenemos ha superado dicha fecha deberemos cambiarla. Enviamos a nuestros clientes siempre una goma homologada fabricada en el mes en curso y con 5 años por delante de vida útil (la foto que aparece es orientativa)

Válvulas de seguridad para gases

Interruptor de seguridad para estufa de gas, estufa de gas para acampar al aire libre, interruptor de seguridad, adaptador de válvula inflable de carga, equipo de campamento(ROJO)
- 【Operación fácil】Simplemente instale la válvula del quemador exterior en el tanque de gas y estará lista para usar. Operación simple y conveniente, brindando una excelente experiencia de uso.
- 【Material Premium】 La válvula de control del tanque de gas plano está hecha de materiales de aleación de cobre y aluminio de alta calidad, que no son fáciles de oxidar, duraderos, seguros de usar y pueden prevenir eficazmente las fugas de gas.
- 【Tamaño apto para uso】El diámetro de entrada de la válvula de admisión es de aproximadamente 10 mm/0,4 pulgadas, y el diámetro de la entrada de escape es de aproximadamente 4 mm/0,2 pulgadas. Confirme que el tamaño del producto es adecuado para el tanque de combustible que compró.
- 【Escenas aplicables】Accesorios de estufa útiles para acampar al aire libre, hacer mochileros, pescar, asar a la parrilla, hacer un picnic, propietarios de casas ahorrativas que se preparan para emergencias, etc.
- 【Ampliamente aplicable】Esta válvula tiene una amplia gama de aplicaciones. Se puede conectar a un tanque de combustible plano para usar en casa o para actividades al aire libre.


Uadme Válvula de Estufa de Gas, Estufa de Gas para Acampar al Aire Libre Cambio de Seguridad Adaptador de válvula Inflable de Carga Equipo de Campamento(Amarillo)
- Aleación de aluminio y cobre: la válvula de control del tanque de gas plano está hecha de materiales de aleación de aluminio y cobre de alta calidad, que no son fáciles de oxidar, duraderos, seguros de usar y pueden prevenir fugas de gas de manera efectiva.
- Operación simple: simplemente instale la válvula del quemador exterior en el tanque de gas y estará lista para usar. Operación simple y conveniente, brindando una excelente experiencia de uso.
- Tamaño del producto: el diámetro de entrada de la válvula de admisión es de aproximadamente 10 mm/0,4 pulgadas y el diámetro de la entrada de escape es de aproximadamente 4 mm/0,2 pulgadas. Confirme que el tamaño del producto es adecuado para el tanque de combustible que compró.
- Amplias aplicaciones: esta válvula tiene una amplia gama de aplicaciones. Se puede conectar a un tanque de combustible plano para usar en casa o para actividades al aire libre.
- Escenas aplicables: accesorios de estufa útiles para acampar al aire libre, mochileros, pescar, asar a la parrilla, hacer picnic, propietarios de viviendas ahorrativas que se preparan para emergencias, etc.


MeTer Star Válvula de seguridad de gas propano LPG para control de hoguera de gas con termopar y perilla
- Longitud del termoacoplador de 600 mm punta de cabeza M8 x 1 (esta es una válvula de control de baja presión máxima BTU 50000); al instalar, asegúrate de que la posición de instalación de cada pieza sea precisa, la instalación incorrecta puede conducir a termopares inutilizables, especialmente
- Baja presión de trabajo máxima 1/2 PSI (65 mbar), válvula de control principal probada CE y CSA con rosca macho de 3/8 pulgadas
- Pomo de baquelita negra Platic de 38 mm de diámetro e inserto "D" para válvula de 6,0 a 6,1 mm
- Adecuado para todo tipo de calentadores de baja presión, estufa de barbacoa y hornos. Necesitas empujar la válvula primero y luego girar el eje y mantenerlo durante unos segundos, no se puede pegar inmediatamente puede necesitar 5-15 segundos
Ponte en contacto con nosotros si te falta un acce - Para más detalles de instalación y posibles problemas, consulta la descripción detallada a continuación. Este conjunto de válvula universal requiere alguna capacidad práctica para reemplazo de bricolaje, por favor confirma que tienes alguna pregunta, por favor ponte en contacto con nosotros.


Meter Star Calentador de espacio de gas propano LPG y calentador de patio al aire libre, válvula de seguridad de control de gas
- Válvula de gas de baja presión de 65 mbar, extremo termopar M8 x 1
- Rosca 7/16-20UNS en la salida y 1 M10 x 1 en el lado de la entrada
- Rosca hembra M8 x 1 en el puerto piloto para tubo de cobre o aluminio de 4 mm en el lado del quemador piloto
- Eje para perilla de 8 mm, piezas aprobadas por CE/CSA
- Adecuado para calentador de patio de gas y calentador de espacio de habitación
